安徽省立医院肿瘤科【临床招募】
安徽省立医院肿瘤科【临床招募】肝癌,胆囊癌,胆管癌,食管癌,胰腺癌,肠癌,胃癌临床招募免费治疗
【招募患者人群】
可以申请的人群是经标准治疗无效(治疗后疾病进展或治疗不能耐受)或患者拒绝标准治疗或无有效治疗手段的肝内胆管细胞癌(ICC)、肝细胞-肝内胆管细胞癌混合型、肝外胆管癌(EHCC)、胆囊癌(GBC)患者。
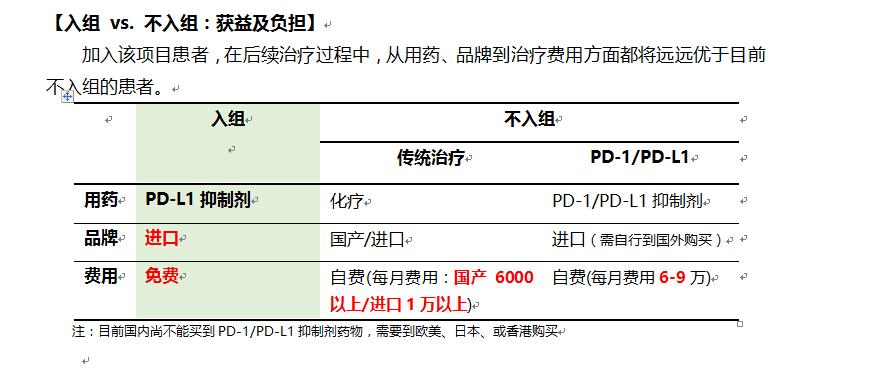
【参加PD-L1抗体KN035临床招募的患者权益】
1. 报名及参与项目不收取任何费用
2. 能够接受最前沿和最专业的检查和治疗;
2. 比其他患者更快地接触到更新、更好的治疗方法,获得更好的疗效和突破;
3. 免费的药物和治疗,可大大减轻经济负担;
4. 参与临床试验会获得医务人员更多的关注,很多医院会为临床试验受试者提供专门的绿色就诊通道,使就诊和治疗变得简单;
5. 个人信息及权益将受到绝对的保护。
报名方式:

肿瘤明星药PD-1/PD-L1抑制剂:开启晚期肺癌治疗新纪元
2018年2月,我国国家癌症中心发布了中国最新癌症数据,汇总了全国449家癌症登记点的数据,肺癌无论是发生率还是死亡率都问鼎榜首,毫无悬念成为我国发生率最高的癌症并且是癌症死亡的最常见原因。2014年我国共有新发肺癌患者78.2万例,死亡62.6万例。
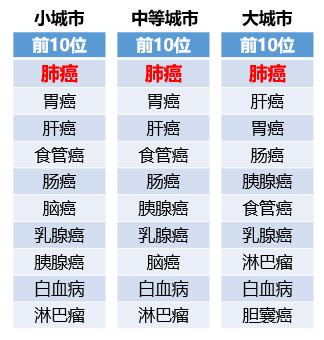
▲肺癌是我国发生率最高的癌症并且是癌症死亡的最常见原因
解剖性肺切除术是早期肺癌的主要治疗手段,也是目前临床治愈肺癌的重要方法。但是,肺癌早期检出率不容乐观,在初诊时57%的肺癌患者已经发生了远处转移,而晚期 ﻪNSCLC 既往的 5 年总生存率小于 ﻪ5%,获得长期生存仍然是患者最迫切的需求。晚期患者的治疗是肺癌治疗体系的重要组成部分,也是近年来研究和进展最多的部分。
晚期NSCLC的治疗原则是以全身治疗为主的综合治疗。由于SCLC的生物学特性与其他组织学类型不同,诊断时广泛期占2/3。化疗是广泛期SCLC最主要的治疗手段,是广泛期SCLC患者的一线标准治疗。难治或耐药复发患者对大多数药物的疗效差,有效率≤10%,敏感复发者的预期有效率约为25%。
在过去的几年里,靶向治疗TKI抑制剂给EGFR基因敏感突变并且不存在耐药基因的的非鳞非小细胞肺癌患者带来了显著的获益。
而驱动基因阴性的患者目前依然以化疗为主,在一线治疗中,化疗总体OS为10个月左右,加上抗血管生成治疗也只有12个月左右。
对于鳞癌患者,因其驱动基因靶点少、生存率低,治疗手段非常有限,二线治疗的标准方案(单药多西他赛)只能给患者带来5~7个月的OS获益。

▲TKI抑制剂靶向治疗仍会发生疾病进展且对EGFR基因不突变的患者无效
对于化疗不良反应不耐受或者发生进展的患者,对于基因检测结果不符合分子靶向治疗的患者,迫切需要新的治疗药物的出现,给予他们新的希望!
【PD-1/PD-L1免疫疗法开启肺癌晚期治疗新纪元】
作为世界上发病率和死亡率居高不下的肺癌一直以来都是科研和临床研究最为迅猛的癌种之一。随着医疗技术的突飞猛进,近年来针对肺癌的治疗也在不断取得突破。其中,以PD-1/PD-L1为代表的免疫治疗的抗癌效果最为令人瞩目。
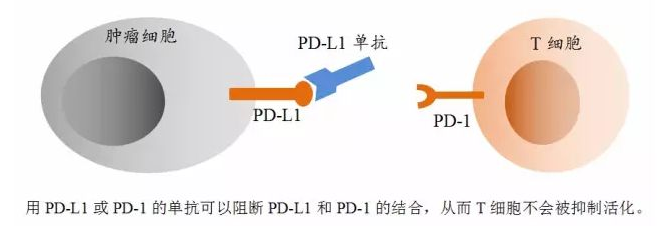
▲肺癌是我国发生率最高的癌症并且是癌症死亡的最常见原因
2015年10月,Keytruda(帕姆单抗)被美国食品药品管理局(FDA)批准用于治疗既往化疗或靶向治疗失败的非小细胞肺癌NSCLC,成为首个被批准用于非小细胞肺癌的免疫治疗药物。
当地时间2016年10月24日,PD-1免疫疗法新药Keytruda(帕姆单抗)获得FDA批准用于一线治疗PD-L1高表达(TPS>50%)的转移性非小细胞肺癌患者。研究招募了305例既往未接受过系统化疗且未携带EGFR或ALK突变的PD-L1高表达(TPS≥50%)NSCLC患者,随机给予帕姆单抗(200mg每3周1次)或标准化疗(培美曲塞+卡铂,培美曲塞+顺铂,吉西他滨+顺铂,吉西他滨+卡铂或紫杉醇+卡铂)。结果表明,与标准的含铂化疗相比,使用帕姆单抗的患者无进展生存期提高50%,总体生存率提高40%。
除了帕姆单抗,PD-1抑制剂Opdivo及PD-L1抑制剂Tecentrip均已经FDA批准用于NSCLC晚期患者治疗,为NSCLC患者提供新的更佳的选择。
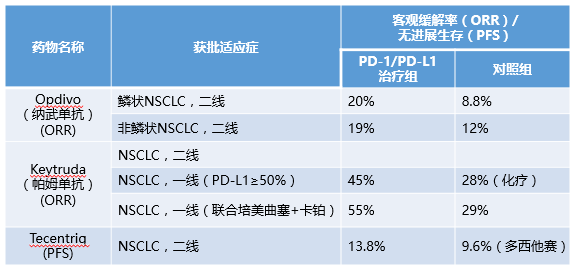
▲多种PD-1/PD-L1抑制剂被FDA批准用于非小细胞肺癌晚期的一线/二线治疗
KN035是全球首个PD-L1单域抗体(皮下注射),意在通过与PD-L1的结合阻断PD-L1与T细胞上PD-1的相互作用,从而解除癌细胞对抗原特异性T细胞的免疫抑制,使T细胞发挥杀伤癌细胞的功能。该项药物已在美国、日本及我国申请展开临床试验,治疗局部晚期或转移性实体瘤,希望能够在包括肺癌在内的多种实体瘤中给患者带去更大的临床获益。
参考文献
1. 石远凯, 孙燕, 于金明, 等. 中国晚期原发性肺癌诊治专家共识 (2016年版)[J]. 中国肺癌杂志, 2016, 19(1): ﻪ1-15.
2. 中国抗癌协会肿瘤临床化疗专业委员会. 中国原发性肺癌诊疗规范(2015年版).
3. Chen W, Zheng R, Zhang S, et al. Cancer incidence and mortality in ﻪChina, 2013[J]. Cancer letters, 2017, 401: 63-71.
4. Chen W, Sun K, Zheng R, et al. Cancer incidence and mortality in China, ﻪ2014. Chin J Cancer Res. 2018 Feb;30(1):1-12.
5. FDA Approves Merck’s KEYTRUDA? (pembrolizumab) in Metastatic NSCLC for ﻪFirst-Line Treatment of Patients Whose Tumors Have High PD-L1 Expression (Tumor ﻪProportion Score [TPS] of 50 Percent or More) With No EGFR or ALK Genomic Tumor ﻪAberrations. Merck & Co., October 24, 2016.
6. Garon EB, Rizvi NA, Hui R, et al.Pembrolizumab for the treat-ment of ﻪnon-small-cell lung cancer[J]. N EnglJ Med, 2015, 372 (21):2018-2028.
7. Rajan A, Gulley JL. Nivolumab (anti-PD- 1, BMS- 936558, ONO-4538) in ﻪpatients with advanced non-small cell lungcan-cer[J]. Transl Lung Cancer Res, ﻪ2014, 3(6):403-405.
8. Lee SM, Chow LQ. A new addition to thePD-1 checkpoint inhib-itors for ﻪnon- small cell lung cancer- the anti- PDL1antibodyMEDI4736[J]. Transl Lung ﻪCancer Res, 2014, 3(6):408-410.
文章来源:ai帮帮微信公众平台