意大利C-Tech种植系统植入同期GBR后稳定性评估
Investigation of peri-implant tissue conditions and peri-implant tissue stability in implants placed with simultaneous augmentation procedure: a 3-year retrospective follow-up analysis of a newly developed bone level implant system
意大利C-Tech种植系统-最新的骨水平种植体三年临床回顾性跟踪报告-植体植入同期行骨增量处理后种植体周围软硬组织稳定性的评估
作者:Jonas Lorenz, Henriette Lerner, Robert A. Saderand Shahram Ghanaati
背景:在牙槽嵴萎缩的病例中,GBR被证明是一个值得信赖的引导骨再生的方法。本次研究的目的是应用西泰克种植体并同期行GBR病例中,种植体周围软硬组织稳定性的评估。
方法:20个患者应用骨替代材料行GBR,同期植入47颗植体。植入后进行3年的临床和放射线检查跟踪。测评项目:种植体成功率、种植体周围角化牙龈的宽度和厚度,龈沟深度,出血指数(BOP)、粉色美学指数(PES)、种植体周围骨吸收量、种植体周围骨缺损
结果:三年跟踪结果显示:种植体成功率100%,龈沟深度2.7mm,BOP是30%。PES平均值10.1,最大值14。种植体周围无明显的骨缺损,骨平均丧失0.55mm。
结论:在牙槽嵴萎缩病例中,西泰克植体植入同期行GBR能够保证种植修复长期功能和美学的满意效果
关键词:C-Tech种植体、引导骨再生(GBR)、口腔种植、种植体周围炎
背景资料:
近些年来,种植体周围炎的发生率逐渐增加,已经成为口腔种植领域主要的问题。长期稳定健康的软硬组织要从功能性和美观性两个方面都要达到满意的效果。然而,过去的十几年伴随着种植数量的增加,种植体周围炎的发病率不断增高。
种植体周围炎是一种种植体周围软硬组织的病理性炎症,它会导致种植体周围的骨吸收。究其病因,相关文献报道是多种多样的。这些因素包括口腔卫生、种植外科风险因素包括植体的位置、软硬组织的质和量、修复理念和修复设计、全身病病史等,这些方面对种植体周围炎的产生和进展都有重要的影响。
种植体周围软组织作为种植体周围第一道屏障,口内微生物的迁移可以引起和加速种植体周围的感染。种植体没有像天然牙一样紧密的屏障保护,种植体周围软组织就像一个袖口结构。与天然牙牙周组织对比,没有结缔组织纤维固定在种植体的表面 。种植体周围的软组织血管化程度很低,更多的是大量胶原细胞。这种解剖结构的不同导致了种植体周围软组织对微生物的防御机制降低 ,而正是这些微生物导致了种植体周围的感染。
种植体周围炎发生的主要病因是种植体在骨内的位置。除此之外,骨质情况、骨血管化和种植体周围骨量是维持种植体长期稳定性和种植体周围软组织稳定非常重要的因素。然而,大部分病例因为牙槽嵴萎缩、慢性炎症和骨组织去除导致骨量不足。因此,近些年来在种植体植入区域采用不同的技术来增加骨量。除了GBR和上颌窦提升技术,不同的骨扩张材料不断的被开发出来 ,并作为常规应用在临床。自体骨移植因为其成骨特性,仍然是硬组织移植金标准。为了避免自体骨移植带来的不足,包括第二术区及术后痛感增加,生物材料集中在骨替代物作为骨再生的支架和周围组织的祖细胞上。
大量的临床试验证明骨替代材料可以形成充足稳定的种植床。然而,还有些不确定因素:不同组织反应对种植体周围感染的影响,特别是当生物材料用于种植体肩台附近的骨增量病例中,由于种植体两段式的结构,种植体肩部和基台连接部分会产生微间隙 ,微间隙为微生物提供聚居空间,进而导致种植体周围炎的发生。
不仅仅生物学和解剖学因素会造成种植体周围软硬组织稳定性的影响,机械因素如种植体和基台之间的连接对种植体长期稳定性也有很重要的影响。种植体和基台的连接部分位于植体的内侧,周围包绕骨和软组织,不同的研究显示莫氏锥度可以减少微间隙,因而减少微动,这种微动会像泵一样将龈沟液和微生物泵入到脆弱的种植体周围软组织间隙中。与植体和基台外连接的方式相比,这种锥形连接会产生一个冷焊效果,更好的防止骨吸收。
对软硬组织健康因素进一步的研究发现,其与种植体和基台之间的锥形连接有关-平台转移设计。通过平台转移,将种植体和基台的连接从植体的外表面转移到内部,这样种植体周围软硬组织的距离更长,减少了细菌定植的可能性。同时,平台转移加上锥形连接减少对种植体周围骨的压力。因此,避免了种植体周围骨组织的吸收,从而使种植体周围软硬组织得到了很好的保护。
本次回顾研究的目的是通过临床和放射线检查来评估和记录种植体周围组织稳定性,所选病例全部行GBR进行骨增量处理,同期植入西泰克种植体并进行了3年的临床跟踪。
研究方法:
患者情况
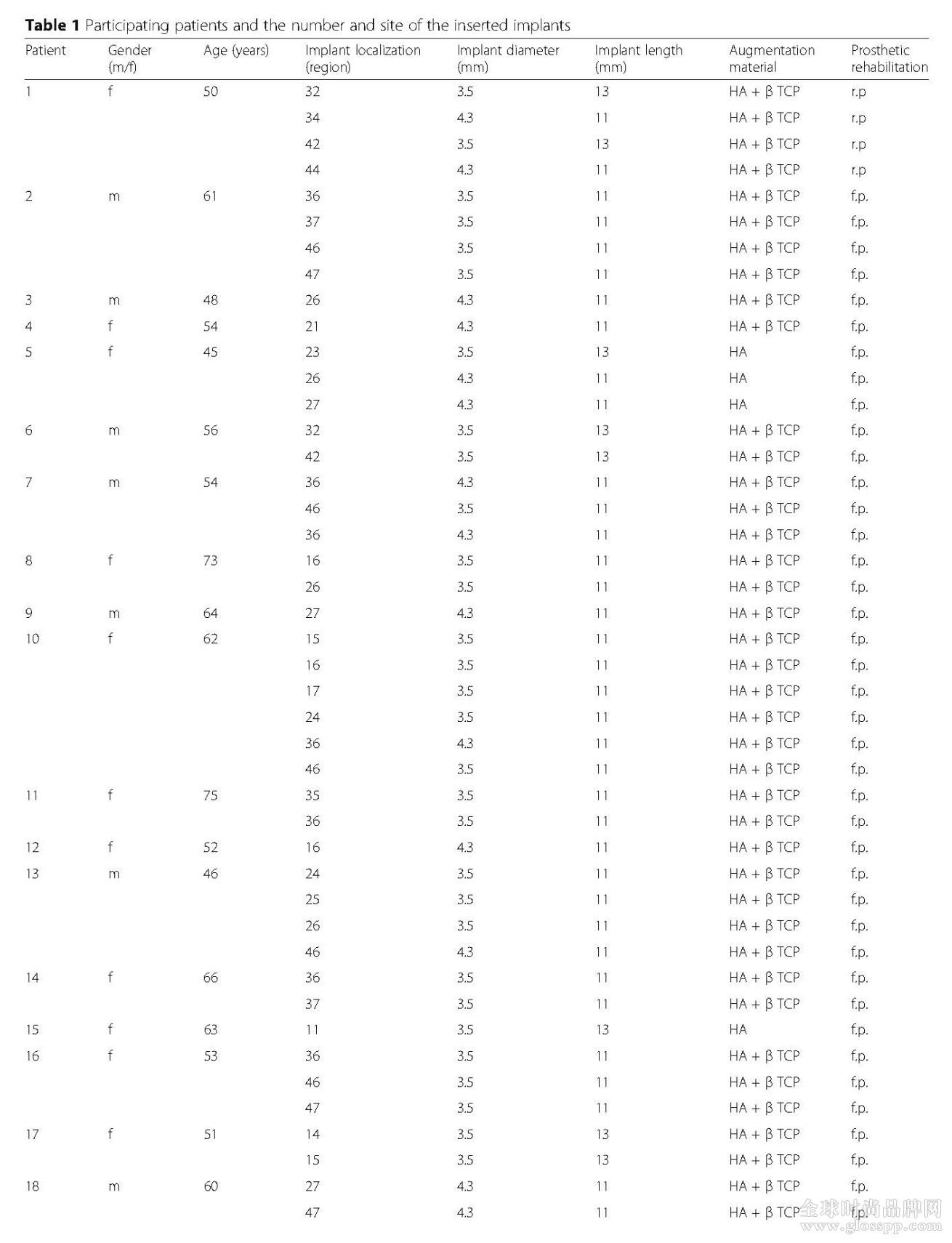
本次研究中,选择了20个患者种植了47颗西泰克EL种植体系统。患者年龄从45-75岁,平均年龄58.5岁,所有病例经过临床和放射线检查并记录。所有的病例治疗在德国巴登巴登HL口腔诊所完成,本实验得到了德国Goethe大学伦理委员会认可通过。所有参与本实验的患者已经签署了同意书,同意实验数据用于出版目的。所有的患者接受了西泰克美学植体种植同期行GBR,术后包括超过一年以上的跟踪观察。而且,植体植入时间最少超过三年。不完整的数据和患者拒绝参与的项目被排除。GBR治疗所用的骨替代材料包括羟磷灰石为主要成分,羟磷灰石混合和β-磷酸三钙三种。人工合成的双相磷酸钙成分的Maxresorb骨粉。成分包括60%的羟磷灰石和40%的β-磷酸三钙。这种骨粉应用在26颗植体,21颗植体使用的是纯羟磷灰石成分的骨替代材料0sbone。
种植体植入位点区,因为植入区垂直向和水平向的骨量不足引起种植体冠端的螺纹暴露。上颌23颗,下颌24颗。所有的种植体拔牙后三个月延期植入,平均4个月的骨结合期。43颗植体种植固定修复,4颗植体可摘式修复。最少三年以上临床和放射线检查跟踪(修复完成36-48个月,平均42.6月)。通过检测牙周出血指数和种植体周围骨边缘高度来分析种植体成功率和种植体周围软硬组织健康情况。
表1为种植患者基本情况、植体植入位点和植体数据(见下页)。
西泰克种植体系统:
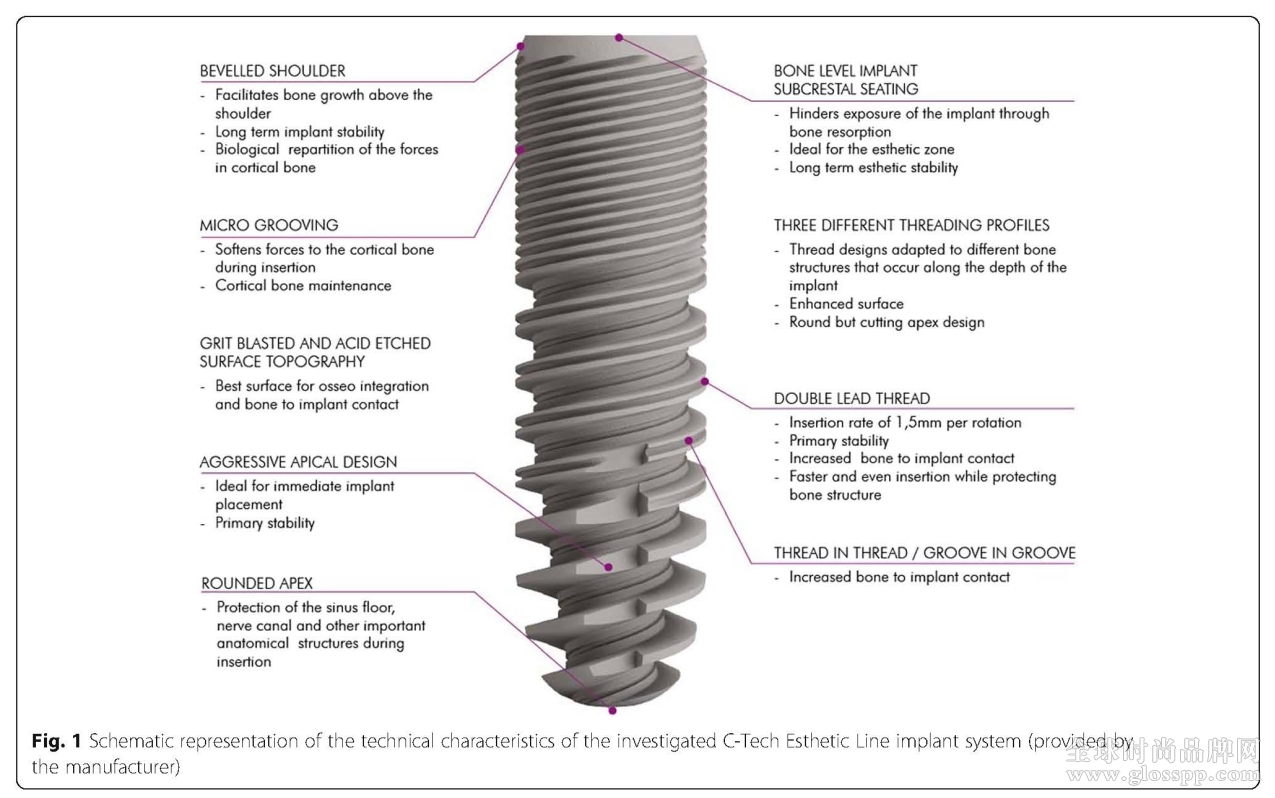
本次实验采用的是意大利西泰克美学种植体系统。该系统为骨水平设计,基台和植体之间采用了莫氏锥度的设计,加上平台转移和内六角设计可以有效防止种植体周围骨吸收。该种植体表面为大颗粒喷砂加上酸蚀处理。植体冠端斜肩台以及三种螺纹设计。
图1;西泰克美学种植体系统的特点

临床和放射线跟踪检查
种植修复后平均3年以上,依照先期文献介绍方法进行临床和放射线检查。用以下参数进行种植体周围软硬组织稳定性的评估:种植体存活率、种植体周围角化的宽度和厚度、牙周探针深度,BOP,种植体周围骨吸收和骨质情况。用钝牙周探针进行4个方向的探诊,包括近颊、远颊、近舌和远舌。牙周探诊深度的同时检测探诊出血情况。
通过检测PES来分析种植体周围的美学效果,通过拍摄对牙合和邻牙的口内照片记录和评估,用PES方法双独立盲式方法。PES包括7个指标-近中龈乳头、远中龈乳头、软组织水平高度,软组织轮廓,牙槽嵴缺失情况,软组织颜色和质地,用打分形式进行评估,0分-非常差,2分-非常好。因此最高分为14分。种植体周围骨损失,通过采用数字化曲面断层片经过放射软件分析。通过测量近中、远中骨高度,计算平均骨损失。
参数考量:
▲种植体位点
▲种植体周围角化牙龈宽度和厚度
▲粉色美学评分(PES)
▲牙周测量
▲出血指数(BOP)
▲种植体周围骨损失
▲种植体周围骨缺损
结果:
20个患者上下颌共植入47颗种植体,因为不同程度的垂直向和水平向的骨量不足,所有种植体植入的同期都采用了骨增量加上植入骨替代材料治疗方法。上颌植入23颗植体,下颌植入24颗植体。种植体的直径包括3.5mm32颗,4.3mm15颗。种植体的长度包括11mm37颗,13mm10颗。修复方式包括固定修复43颗,可摘式修复4颗植体。(表1)
人工合成的骨替代材料成份包括羟磷灰石和β-磷酸三钙。
种植体修复完成后进行了3年的跟踪,所有的种植体100%骨结合成功。未观察到修复并发症、感染和不适反应。
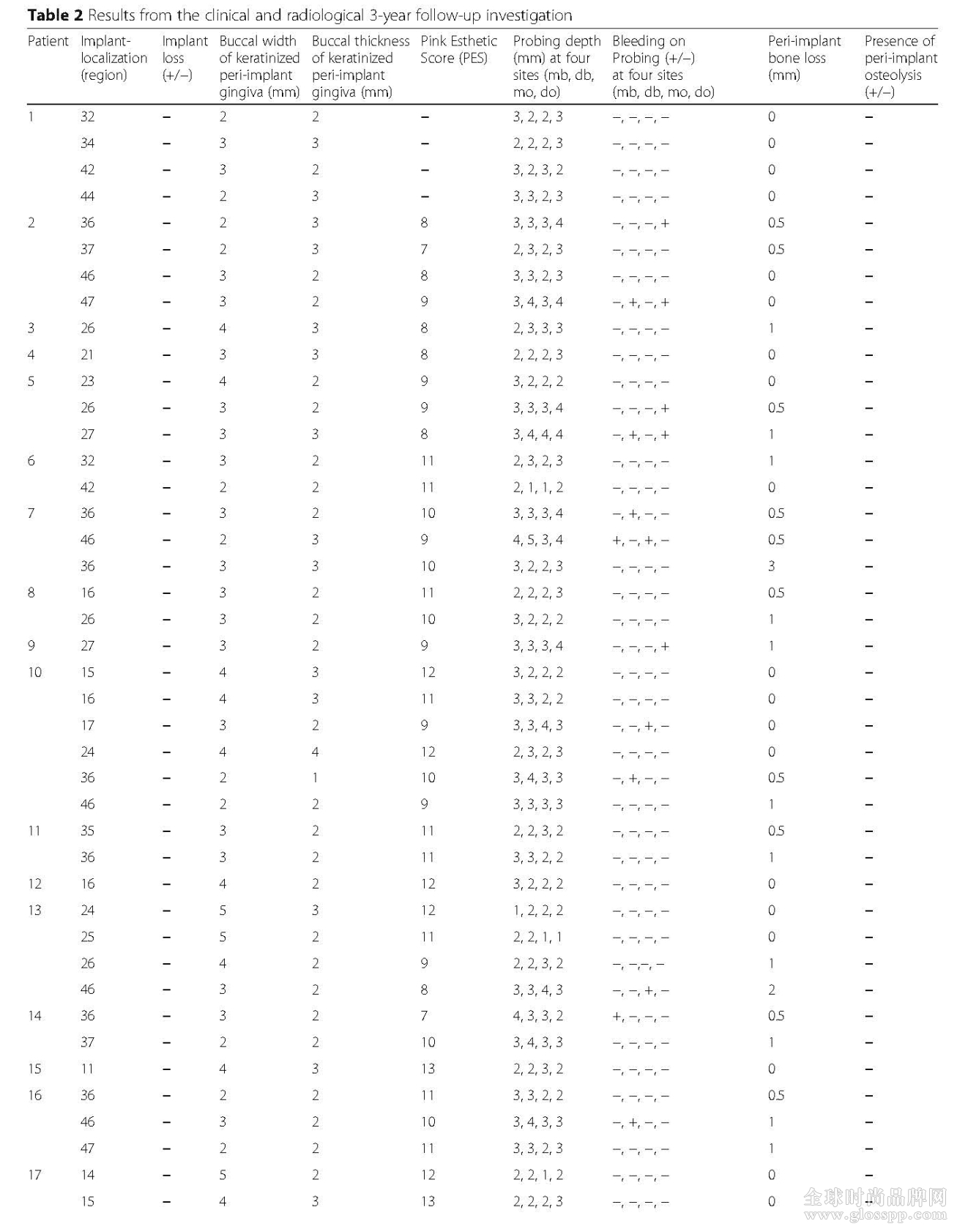
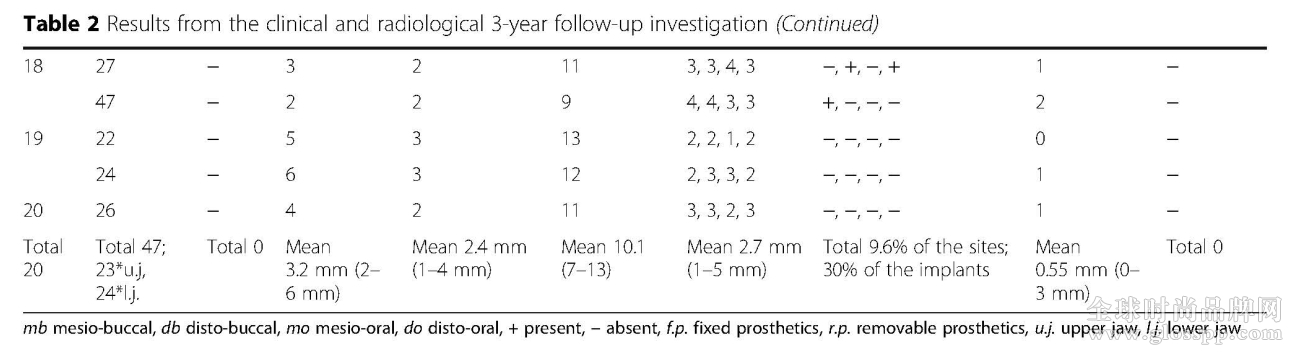
通过探诊深度(PD)和探诊后出血(BOP)检测种植体周围软组织的炎症反应,每个种植体的PD从1-4mm不等,平均深度为2.4mm。47颗种植体中14颗观察到了BOP,绝大多数的种植体在PD增加时,出现BOP。PD和BOP之间的相关性是明显的,绝大多数出现BOP的植体PD都增加了。
本研究中的植体周围附着角化牙龈数量与以下因素相关:种植体周围牙龈角化情况、潜在的炎症反应、种植体周围骨丧失和种植体周围骨量有关。所有的种植体周围角化牙龈的宽度最少1mm宽和1mm厚,宽度从2-6mm,平均3.2mm,厚度从1-4mm,平均厚度是2.4mm。角化牙龈的数量和评估参数(PD和BOP)之间未观察到明显的统计学差异。运用PES进行美学效果的评估,最高分为14分,本次观察得分从7-13分,中位数为10.1分。
种植体周围骨吸收通过测量近远中骨丧失量来评估,骨丧失量从0-3mm不等,平均0.55mm。同时经过3年的负重,放射检查显示种植体周围骨水平稳定。
表2 3年跟踪的临床和影像学结果(见下页)。
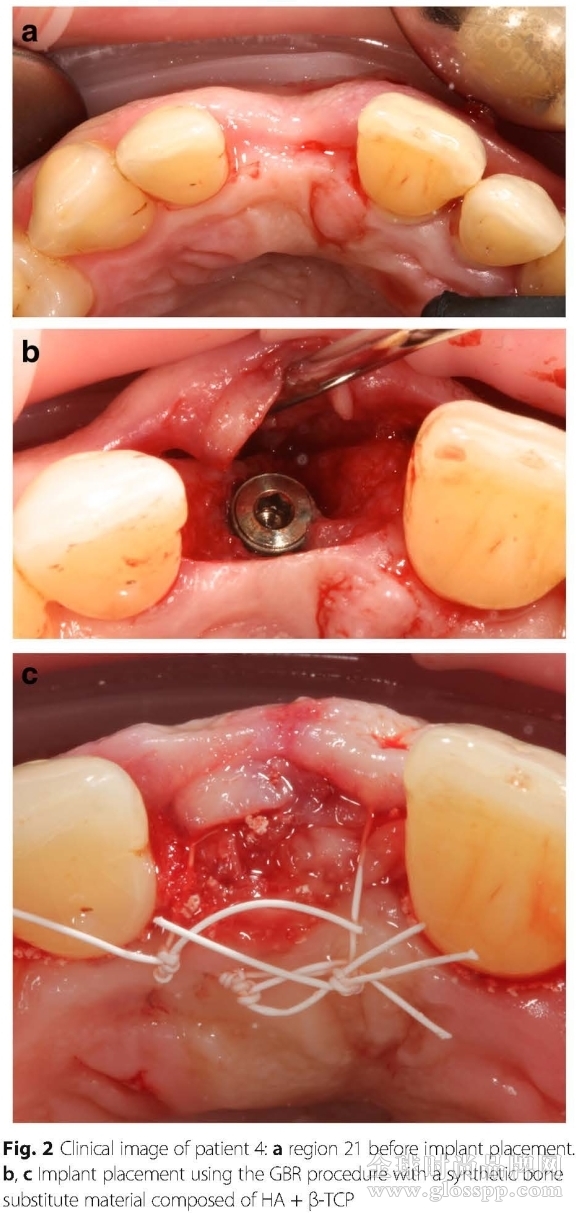
图2显示的是植入植体的患者的口内照片。
讨论:
本次回顾性研究中,通过临床和放射线检查,西泰克骨水平植体同期植入骨替代材料并经过三年负重跟踪,记录种植体周围软组织情况和软组织稳定性。
一共20个患者植入47颗植体,其中上颌23颗,下颌24颗。由于牙槽嵴垂直向和水平向的骨量不足,植体植入的同期采用了GBR来实现骨增量。GBR所用的为人工合成的骨替代材料。临床和放射线检查显示植体的成功率达到100%,PD值在2.7mm比较低的水平,BOP发生率30%。PES平均值为10.1,最大值14。未观察到明显的骨丧失。骨丧失平均值为0.55mm,从0-3mm不等。
我们团队对不同组织源骨替代材料的组织反应进行了广泛的调查。包括骨粉来源、物理化学结构和骨增量技术,这些因素在骨增量区域的细胞反应有重要的影响。在临床研究中,通过组织学和组织形态计量研究两段式上颌窦提升病例中,人工合成骨、羟磷灰石和小牛骨成分的组织反应进行了对照。研究显示,与异种骨相比,人工合成的骨替代材料中MNGCs细胞表达更显著。然而,在种植床内,诱导MNGCs组织反应产生更显著的血管化。对于种植床内的新骨形成的观察,必须提及的是经过六个月骨整合期新骨形成的效果中,人工合成骨和异种骨之间没有显著性差异。
结论:
在本研究中,3年的随访调查显示西泰克植体生存率为100%,探诊深度(2.7mm)和BOP(30%)。此外,PES分析显示种植修复冠和软组织具有良好的美学外观。用于GBR的合成HA和HA+β-磷酸三钙基骨替代材料未见对种植体周围健康产生负面影响。综上所述,西泰克骨水平种植系统在骨增量同期植入骨替代材料(GBR)病例中,可以获得功能和美学上令人满意的结果。
References:
1. Gurgel BC, Montenegro SC, Dantas PM, Pascoal AL, Lima KC, Calderon PD.Frequency of peri-implant diseases and associated factors. Clin Oral Implants Res. 2016; doi: 10.1111/clr.12944
2. Qian J, Wennerberg A, Albrektsson T. Reasons for marginal bone loss around oral implants. Clin Implant Dent Relat Res. 2012;14(6):792–807.
3. Berglundh T, Lindhe J, Ericsson I, Marinello C, Liljenberg B, Thomsen P.The soft tissue barrier at implants and teeth. Clin Oral Implants Res.1991;2:81–90.
4. Berglundh T, Lindhe J, Jonsson K, Ericsson I. The topography of the vascular systems in the periodontal and peri-implant tissues in the dog.J Clin Periodontol. 1999;21:189–93.
5. Moon I, Berglundh T, Abrahamsson I, Linder E, Lindhe J. The barrier between the keratinized mucosa and the dental implant. An experimental study in the dog. J Clin Periodontol. 1999;26:658–63.
6. Lindhe J, Berglundh T. The interface between the mucosa and the implant.Periodontol. 1998;17:47–54.
7. Masaki C, Nakamoto T, Mukaibo T, Kondo Y, Hosokawa R. Strategies for alveolar ridge reconstruction and preservation for implant therapy.J Prosthodont Res. 2015;59(4):220–8.
8. Damien CJ, Parsons JR. Bone graft and bone graft substitutes: a review of current technology and applications. J Appl Biomater.1991;2:187–208.
9. Cordaro L, Torsello F, Miuccio MT, di Torresanto VM, Eliopoulos D.Mandibular bone harvesting for alveolar reconstruction and implant placement: subjective and objective cross-sectional evaluation of donor and recipient site up to 4 years. Clinical Oral Impl Res.2011;22:1320–6.
10. Canullo L, Penarrocha-Oltra D, Soldini C, Mazzocco F, Penarrocha M, Covani U.Microbiological assessment of the implant-abutment interface in different connections: cross-sectional study after 5 years of functional loading. Clin Oral Implants Res. 2015;26(4):426–34.
11. Misch C. Implant design considerations for the posterior regions of the mouth. Implant Dent. 1999;8(4).
12. Steigenga J, al-Shammari K, Nociti F, Misch C, Wang H. Dental implant design and its relationship to long-term implant success. Implant Dent.2001;12(4):306–17.
13. Canullo L, Pace F, Coelho P, Sciubba E, Vozza I. The influence of platform switching on the biomechanical aspects of the implant-abutment system.A three dimensional finite element study. Med Oral Patol Oral Cir Bucal.2011;16(6):852–6.
14. Lerner H, Lorenz J, Sader R, Ghanaati S. Two-year retrospective study of periimplant health and periimplant bone stability after immediate implant placement of a newly developed bone level implant system—a first report.EDI Journal (European Association of Dental Implantologists, Teamwork Media); 2017; ahead of print.
15. Ghanaati S, Lorenz J, Obreja K, Choukroun J, Landes C, Sader R.Nanocrystalline hydroxyapatite-based material already contributes to implant stability after 3 months: a clinical and radiologic 3-year follow-up investigation. In: Journal of Oral Implantology. 2014;40(1):103–9.
16. Lorenz J, Kubesch A, Korzinskas T, Barbeck M, Landes C, Sader R, et al. TRAPpositive multinucleated giant cells are foreign body giant cells rather than osteoclasts: results from a split-mouth study in humans. J Oral Implantol.2015;41(6):e257–66.
17. Barbeck M, Udeabor S, Lorenz J, Schlee M, Grosse Holthaus M, Raetscho N,et al. High-temperature sintering of xenogeneic bone substitutes leads to increased multinucleated giant cell formation: in vivo and preliminary clinical results. J Oral Implantol. 2015;41(5):e212–22.
18. Barbeck M, Udeabor S, Lorenz J, Kubesch A, Choukroun J, Sader R, et al.Induction of multinucleated giant cells in response to small sized bovine bone substitute (Bio-Oss TM) results in an enhanced early implantation bed vascularization. Ann Maxillofac Surg. 2014;4(2):150–7.
19. Lorenz J, Barbeck M, Sader R, Russe P, Choukroun J, Kirkpatrick CJ, et al.Foreign body giant cell related encapsulation of a synthetic material three years after augmentation. J Oral Implantol. 2016;42(3):273–7。